Qualquer um que tenha um pouco de conhecimento sobre Biologia não irá ter dúvidas em
dizer que o DNA é importante. A dupla fita em forma helicoidal é um símbolo da
Biologia. Os livros de Ensino Médio costumam propor, na apresentação dos capítulos,
definições interessantes. Por exemplo, no livro Biologia, de Armênio Uzunian e Ernesto Birner, é dito: "o DNA
contém toda a nossa informação genética", "é a molécula que faz com
que cada um de nós seja único e especial", "é o DNA quem comanda
todas as atividades da célula" e "o DNA possui a receita para o
funcionamento da célula".
Isso
tudo é verdade. Como falamos neste artigo, o DNA é uma grande biblioteca. E a
evolução privilegiou essa forma de guardar informações justamente pelo seu
mecanismo de autoduplicação (replicação do DNA). Dessa forma, a informação genética
é sempre copiada, de modo semiconservativo, quando uma célula se divide –
podendo ser transmitida para outras gerações. Mas toda a informação genética
codifica o que? O que uma sequência repetitiva de bases nitrogenadas – adenina,
timina, citosina e guanina – guardam de tão importante? Como que o DNA faz que
cada um de nós seja "único e especial" (creio que os autores estão
presumindo que você não tem um irmão gêmeo univitelino)?
 |
| Usando uma analogia, podemos dizer que o conjunto de cromossomos é um grande livro de receitas. O gene é uma receita em particular. O RNAm é cópia dessa receita. O produto da receita é a proteína |
A
informação genética, guardada no núcleo, dá a receita para a construção de
proteínas. E há uma variedade gigante dessas máquinas que realizam as mais
diferentes reações químicas e mecânicas. Nosso corpo tem muita proteína. Depois da água, as proteínas são os compostos mais abundantes. E necessitamos dela para praticamente tudo. Até mesmo para ser copiado, o DNA
precisa de proteínas (entre elas, a DNA polimerase) – isoladamente, ele não é
nada. São as proteínas que realmente fazem todo o "trabalho" nas células.
E elas são trabalhadoras especializadas. Cada gene codifica uma proteína – após
a síntese proteica, formará-se uma molécula que terá um formato específico, terá
cargas elétricas específicas, possuirá um sítio ativo de diâmetro específico. E
isso tudo a permitirá interagir com uma molécula... específica. Não há como fugir desse conceito ao falar de proteínas:
"especificidade molecular".
A
variedade de proteínas que construímos e as funções que elas exercem são inumeráveis
(na verdade, são numeráveis, sim: temos aproximadamente 30.000 tipos de proteínas
diferentes).
Se
você está lendo esse texto, agradeça à várias proteínas! Raios luminosos entram
nos seus olhos atravessando a pupila. Uma segunda "barreira" é o
cristalino – ele possui uma mistura densa de proteínas que permitem a focalização
da imagem. Logo em seguida, a luz chega à retina, no fundo do olho. Lá, há 100
milhões de células fotossensíveis – os cones e os bastonetes. Os cones possuem
fotopigmentos, que se associam a proteínas e são capazes de absorver espectros luminosos de frequência
específica. Os
bastonetes são nossos sensores de luz: eles contêm opsina, uma proteína transmembranar
que se liga a um derivado da vitamina A (retinal) para capturar a luz (sendo, então, chamado de rodopsina). Em todos os casos,
os fotopigmentos, ao absorverem a luz, sofrem reações químicas reversíveis que gera um efeito em cascata que culmina num impulso nervoso dirigido ao nervo óptico.
Mas
mesmo isso depende de proteínas: não fossem os canais iônicos de sódio e potássio
repolarizando os neurônios, o impulso não seria transmitido. Mas, para manter o
transporte ativo de íons, os neurônios gastam energia. Não fosse pela ATP
sintase, uma das proteínas da respiração celular, os neurônios não teriam tal
energia. A ATP sintase é uma enzima que funciona como uma roleta: ela é capaz
de girar em torno de seu próprio eixo e, assim, produzir energia. O principal
combustível que ela usa é a glicose. Acontece que glicose só entra na célula
porque existe uma porta de entrada específica para ela. A proteína GLUT4 tem um
encaixe perfeito para permitir a capturação da glicose, nutriente tão
importante para os neurônios e todas as células do corpo. Mas essa porta de
entrada é por vezes trancada. A abertura acontece com a presença de insulina –
um hormônio que, na realidade, é uma proteína. Mas até mesmo para obter a
glicose, temos que usar proteínas. A glicose chega à sua boca, principalmente,
na forma de amido. E logo aí uma enzima, a amilase salivar, começa a atuar: ela
quebra o amido em maltose (há também uma amilase no intestino delgado). Mais
tarde, a maltose é degradada em glicose por meio da enzima maltase.
Como
é possível notar, cada proteína realiza um trabalho específico e, no fim das
contas, é o trabalho em conjunto delas que permite todo o funcionamento da célula.
Mas como que elas conseguem ser tão especializadas e ter arranjos geométrico-espaciais
tão diversos? Assim como os ácidos nucleicos, elas são formadas por partes
menores que vão se encaixando.
 |
| Estrutura da glicina, o aminoácido mais simples. Observe o grupo carboxílico e o grupo amina |
Alguns aminoácidos interagem fortemente com água
e íons. Outros possuem longas cadeias contendo carbono e hidrogênio, sendo mais
hidrofóbicos. Alguns aminoácidos são quimicamente reativos e outros são
neutros. Alguns deles são moléculas grandes, outros são menores. É essa
diversidade de aminoácidos que permitem um grande número de combinações – e de
arquiteturas.
 |
| A sequência de aminoácidos é essencial para determinar a estrutura terciária da proteína |
A
sequência de aminoácidos é fundamental. A substituição de um único aminoácido
por outro pode fazer com que a proteína perca sua função. A anemia falciforme,
por exemplo, é causada pela troca do ácido glutâmico (de carga negativa) por
valina (de carga neutra) na cadeia beta da globina (que forma a hemoglobina). Por
que isso modifica tanto a proteína? É que as proteínas raramente assumem uma
estrutura linear (estrutura primária). Há interações entre os aminoácidos –
isso gera uma estrutura helicoildal (estrutura secundária). Mais comum ainda é
que, em meio aquoso, como nas células; elas realizam um último "truque":
dobram-se sobre si mesma, encontrando uma geometria ótima. Os aminoácidos
hidrofóbicos ficam "protegidos" no interior dessa estrutura, enquanto
os aminoácidos hidrófilos ficam na superfície, interagindo com as moléculas de água
circundante. É essa estrutura terciária que nos garante a especificidade
molecular, tornando-as proteínas capazes de realizar tantas funções diferentes.
Há
ainda a estrutura quaternária, quando duas proteínas diferentes se ligam. A
hemoglobina do nosso sangue, por exemplo, possui quatro cadeias polipeptídicas
de dois tipos diferentes, ligados a um grupo que contém ferro (o grupo heme).
A
forma das proteínas depende, em última análise, da ordem de aminoácidos. E a
ordem de aminoácidos é determinada pela ordem de nucleotídeos no DNA! A receita
para fazer as proteínas está lá. Uma pequena mudança na ordem de bases
nitrogenadas poderá resultar numa mudança na ordem de aminoácidos. Com isso,
formam-se proteínas que não assumem o aspecto tridimensional perfeito para a
sua função. E são muitas as funções possíveis.
Funções das proteínas
A seguir estão descritas algumas funções das proteínas:
Papel estrutural
 |
| O citoesqueleto é fundamental para a consistência da célula |
As
proteínas fazem parte da arquitetura de todas as células. Elas se encontram no
citoesqueleto: uma rede de fibras proteicas que mantém o citosol estável e dá
consistência ao conteúdo celular. Além disso, assumem outras funções. Por
exemplo, a actina, um microfilamento, pode se associar à miosina, na presença
de ATP e íons cálcio. Isso permite a contração muscular e os movimentos de células
como neutrófilos. A queratina ocorre, por exemplo, na epiderme e tem função
impermeabilzante.
Papel enzimático
As
proteínas podem ser enzimas – que são altamente específicas. Sua função é a de
um catalisador: elas diminuem a energia necessária para que uma reação química
aconteça. São milhares as reações químicas que acontecem em nossas células – e milhares
são as enzimas que catalisam tais reações.
As
enzimas possuem um sítio ativo, isto é, um lugar específico para o encaixe de
um substrato – o reagente da reação. O complexo enzima-substrato, formado por
esse encaixe perfeito, garante a ocorrência da reação química. Por exemplo: a
sacarose se encaixa na enzima sacarase, o que acelera a reação de sua hidrólise.
Forma-se uma molécula de glicose e uma de frutose no fim do processo. A enzima,
por apenas atuar como catalisador, não é consumida na reação química.
Erros
na sequência de nucleotídeos do código genético podem gerar mudanças na sequência
de aminoácidos e produzir enzimas com sítio ativo defeituoso. Como sempre, o formato
e as interações químicas que a enzima realiza devem ser específicos, a fim de
que se forme o complexo enzima-substrato. Desse modo, uma mutação pode impedir
que ela desempenhe sua função. Um exemplo (talvez não o mais famoso) é a doençade Tay Sachs. Trata-se de uma doença genética neurodegenerativa. Nela, há a
modificação de um único aminoácido na sequência de uma enzima que catalisa a
degradação de gangliosídios GM2 – uma substância glicolipídica que é tóxica em
níveis altos. A mutação gera uma proteína não-funcional. Resultados: os
gangliosídios GM2 se acumulam, o que acaba levando à necrose dos neurônios e,
eventualmente, a morte.
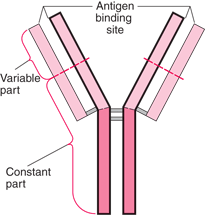 |
| Esquema de um anticorpo. Observe que há uma parte variável: isso garante a especificidade para uma diversidade de antígenos |
Armazenamento/transporte
A
hemoglobina tem uma estrutura específica que lhe permite afinidade com o oxigênio.
Através do tecido sanguíneo, ela é capaz de levar o oxigênio a todas as células
do corpo.
Proteínas de membrana
 |
| Esquema da bomba de sódio e potássio: ela mantém o nível de sódio alto no exterior da célula e o nível de potássio alto no interior da célula |
Ocorrem
várias proteínas na membrana plasmática das células. Elas têm funções distintas.
Muitas
proteínas participam do processo de difusão facilitada. Elas flutuam junto com
os lipídios na membrana plasmática das células. Elas têm formatos específicos
que garantem a interação com certas substâncias e a difusão delas para o meio
intracelular. Por exemplo, temos receptores para a água (aquaporina) e
transportadores de glicose (transportadores GLUT4).
As
proteínas de membrana podem também gerar uma reação em cadeia quando se
combinam com suas moléculas específicas (um processo chamado de "transdução").
Por exemplo, a acetilcolina é um neurotransmissor. Quando a acetilcolina
encontra seus receptores na membrana da fibra muscular, ocorrem várias reações
químicas que culminam na contração muscular.
Algumas
proteínas de membrana atuam no transporte ativo de substâncias. A bomba de sódio
e potássio, por exemplo, garante que haja no tecido nervoso uma diferença de
potencial entre o meio intra e extracelular. O sódio é bombeado para fora da célula
e potássio é transportado ativamente para dentro da célula. Ela necessita de
ATP constantemente para manter esse estado "artificial" (pois vai
contra as leis fisico-químicas de difusão). Tal polarização no neurônio é
essencial para que sejam transmitidos os impulsos nervosos.
Desnaturação
A
conformação tridimensional das proteínas garante que elas sejam capazes de
desempenhar as funções mais diversas nas células. Contudo, mudanças na
temperatura ou no grau de acidez (pH) podem destruir as ligações químicas que
formam a arquitetura proteica e, com isso, torná-las inúteis. Caso a estrutura
tridimensional da enzima se rompa, ocorre a desnaturação. A proteína perde sua
função quando isso ocorre.
Inibição competitiva
Proteínas receptoras são específicas para determinada molécula - graças às cargas elétricas que possuem e ao tamanho de seu sítio ativo. No entanto, em alguns casos, essas proteínas se ligam a mais de uma molécula. Se uma segunda molécula for muito parecida, ela consegue se encaixar na proteína - e pode produzir o mesmo efeito da proteína original ou mesmo antagonizá-los. Esse mecanismo é chamado de inibição competitiva, pois duas moléculas competem pelo mesmo sítio ativo. Inclusive, é usando esse mecanismo de inibição que a cafeína nos deixa acordado. Para conhecer melhor, clique aqui. Essa inibição é reversível. Há algumas, porém, como a inibição alostérica, que são irreversíveis.




Nenhum comentário:
Postar um comentário